Lee detenidamente la siguiente lectura:
Observa detenidamente la siguiente imagen:
Ahora en tu portafolio, responde a las siguientes preguntas:
1. ¿Tienen los mismos elementos los compuestos que observas?
2. ¿Cuál es la diferencia química entre ambos compuestos?
“A explicar las diferencias entre los compuestos químicos orgánicos e inorgánicos, mediante resolución de situaciones problemáticas, para entender sobre los compuestos inorgánicos”
Formulación Química: es la representación simbólica de una sustancia pura, elemento o compuesto, que nos informa sobre su composición.
La interpretación de la fórmula depende del tipo de sustancia:
La fórmula de una sustancia puede ser representada de forma abreviada o desarrollada. Por ello existen varios tipos de fórmulas.
Sistemas de Nomenclatura: la denominación correcta de las sustancias químicas en base a determinadas normas es tarea principal de la nomenclatura química científica.
 Actualmente son tres las nomenclaturas en uso: la nomenclatura tradicional, la nomenclatura stock y la nomenclatura sistemática.
Actualmente son tres las nomenclaturas en uso: la nomenclatura tradicional, la nomenclatura stock y la nomenclatura sistemática.
- Nomenclatura tradicional: emplea sufijos y, en algunos casos, prefijos para indicar el número de oxidación con el que actúan los elementos dentro de un compuesto. Por ejemplo, FeO es denominado óxido ferroso.
- Nomenclatura stock: el número de oxidación del elemento se indica con romanos y entre paréntesis, seguido del nombre. Si en el compuesto interviene un elemento con numero de oxidación constante, no es necesario indicarlo. Por ejemplo, FeO es denominado óxido de hierro (II).
- Nomenclatura sistemática: las proporciones en que se encuentran los elementos pueden indicarse por medio de prefijos griegos.
Por ejemplo, FeO es denominado monóxido de hierro.
 La IUPAC (Unión Internacional de Química Pura y Aplicada), como organismo que regula las normas de formulación y nomenclatura, recomienda el uso tanto de la nomenclatura Stock como de la sistemática, salvo casos especiales.
La IUPAC (Unión Internacional de Química Pura y Aplicada), como organismo que regula las normas de formulación y nomenclatura, recomienda el uso tanto de la nomenclatura Stock como de la sistemática, salvo casos especiales.
El uso de este lenguaje es imprescindible para expresar de forma precisa las reacciones y los fenómenos químicos.
Clases de compuestos químicos: para facilitar el estudio de los compuestos químicos, estos han sido clasificados e dos grandes grupos: orgánicos e inorgánicos.
Funciones químicas inorgánicas: son los compuestos con propiedades físicas y químicas semejantes debido a que presentan un mismo grupo funcional.
Existen alrededor de cien mil compuestos inorgánicos resultantes de la combinación de distintos elementos. Según el número de elementos que los conforman, los compuestos se clasifican en los siguientes tipos:
- Compuestos binarios: formados por dos tipos de átomos diferentes. Por ejemplo, SO2.
- Compuestos ternarios: formados por tres tipos de átomos diferentes. Por ejemplo, HClO.
- Compuestos cuaternarios: formados por cuatro tipos de átomos diferentes. Por ejemplo, NaHCO3.
También se les agrupa por sus características en familias de compuestos, llamadas también químicas inorgánicas. Comprenden las siguientes clases:
Número de oxidación: es el número de oxidación que un átomo gana, pierde o comparte al formar un compuesto. Es negativo si gana electrones y positivo si los pierde. En el siguiente sistema periódico aparecen los números de oxidación de los elementos más comunes.
Observa detenidamente la siguiente imagen:
Ahora en tu portafolio, responde las siguientes preguntas:
1. ¿Cómo se llama la propiedad de la materia donde hacemos uso de los sentidos?
2. ¿Qué elementos forman la sustancia de la imagen? ¿Químicamente, qué nombre recibe?
“A explicar que la combinación de sustancias depende de sus enlaces, mediante resolución de situaciones problemáticas, para entender sobre los enlaces químicos”
Enlaces Químicos: los gases nobles son los únicos elementos que se encuentran en la naturaleza como átomos individuales, pues son muy estables. Los átomos del resto de los elementos se mantienen unidos. Esta unión se denomina enlace químico. Un enlace químico es un conjunto de fuerzas que mantiene unidos a los átomos, los iones y las moléculas para formar agrupaciones estables.
Los enlaces químicos que poseen las sustancias pueden ser iónicos, covalentes o metálicos.
Para explicar cómo se producen los enlaces químicos, se utiliza la regla del octeto y la electronegatividad
1. Regla del octeto: los átomos de los gases nobles presentan 8 electrones en su ultimo nivel, por lo que se les considera estables. La única excepción es el helio, que tiene 2 electrones.
En 1916, el estadounidense Gilbert Lewis y el alemán Walter Kossel propusieron, independientemente, la regla del octeto, que sostiene que cuando se forma un enlace químico, los átomos reciben, ceden o comparten electrones con otros átomos, buscando todos tener 8 electrones en su último nivel de energía para adquirir la configuración del gas noble más próximo de la tabla periódica.
ENLACE IÓNICO: Se caracteriza:
- Porque se da principalmente entre un metal (IA o IIA) y un no metal (VIA o VIIIA)
- Porque su diferencia de electronegatividades entre los átomos es mayor o igual a 1,7.
- Por la transferencia del átomo menos electronegativo al más electronegativo.
ENLACE COVALENTE: Se caracteriza:
- Por la comparación de  de los átomos que forman el enlace.
de los átomos que forman el enlace.
- Porque se da entre no metales
- Por la multiplicidad del enlace, puede ser: simple, doble, triple.
- En el Enlace Polar la compartición de  es desigual.
es desigual.
- En el Enlace Apolar la compartición de  es equitativa.
es equitativa.
- En el Enlace Coordinado o Dativo un átomo es el que aporta los 2 del enlace.
del enlace.
2. Electronegatividad: es una medida de la capacidad del átomo de atraer electrones en un enlace químico. Este factor permite la captura de electrones de valencia entre los átomos que forman el enlace. De acuerdo con esto, los elementos son electronegativos o electropositivos.
Elementos electropositivos = Tienden a ceder electrones
Elementos electronegativos = Tienden a ganar electrones
Por ejemplo, el magnesio y el oxígeno se unen para formar el óxido de magnesio (MgO). El elemento electropositivo es el magnesio, pues cede electrones; el oxígeno es electronegativo, pues gana electrones.
Conocer la electronegatividad de los elementos que forma un enlace es muy útil porque a partir de su diferencia se puede predecir que tipo de enlace se formará.
En tu portafolio, responde las siguientes preguntas a manera de reflexión:
- ¿Qué es lo que aprendí hoy?
- ¿Cómo puedo aplicar lo aprendido hoy en mi vida cotidiana?
Recuerda que esta parte es solo para poder responder lo que se sabe, si no entiendes alguna pregunta no te preocupes, más adelantes lo analizaremos.
“A explicar que la ubicación de los elementos químicos en la tabla periódica varía en relación con las propiedades periódicas, mediante resolución de situaciones problemáticas, para entender las propiedades periódicas en la tabla periódica moderna”
Propiedades Periódicas: las propiedades periódicas de los elementos químicos varían en relación con el lugar que ocupan en el sistema periódico.
Es momento de describir lo que aprendimos:
¿Cómo empezamos?
Observa la siguiente imagen:
Ahora, responde a las siguientes preguntas:
¿Qué aprenderé hoy?
“A explicar la organización de los elementos químicos en grupos y periodos, mediante resolución de situaciones problemáticas, para entender la organización de la tabla periódica moderna”
¿Qué haré?
Clasificación de los elementos:
Triadas de Döbereiner (1817)
El químico alemán Johan Döbereiner (1780 - 1849) agrupa los elementos hasta entonces conocidos en serie de tres elementos llamándoselos Triadas. Los elementos que pertenecen a una triada poseen propiedades químicas semejantes.
Ejm.
 Octavas de Newlands (1864)
Octavas de Newlands (1864)
El químico inglés John Alexander Reina Newlands (1838 - 1898) ordeno los elementos químicos en grupo de 7 elementos cada uno, en función creciente a sus P.A. de tal modo que el octavo elemento tenía propiedades semejantes al primer elemento del grupo anterior. Esta forma de clasificar a los elementos se llamó Ley de las Octavas.
Ejm.
Tabla Periódica de Mendeléiev – Meyer (1869)
El químico ruso Dimitri Ivanovich Mendeléiev (1836 - 1907) y el químico alemán Julios Lotear Meyer (1830 - 1895), trabajando independientemente la Primera Tabla Periódica (T. P. Corta).
- Meyer Þ Prop. Físicas (volumen atómico)
- Mendeléiev Þ Prop. Químicas (valencia, E.O.)
Criterios:

- P.A. Creciente
- Dejaron espacios vacíos pronosticando el descubrimiento de nuevos elementos, hasta entonces había 63 elementos.
- La tabla posee 8 grupos.
Tabla periódica moderna:
También conocida como tabla periódica larga o de Werner y Paneth, se organiza en grupos y periodos.
Periodos: son siete filas de elementos designados con números del 1 al 7. El numero del periodo indica el nivel energético mas externo. Los periodos 1, 2 y 3 contienen pocos elementos, mientras que los periodos 4, 5, 6 y 7 son más largos.
Grupos: también llamados familias, están constituidos por las columnas. Los elementos de un mismo grupo tienen propiedades químicas semejantes. Hay dieciocho grupos (1 al 18). Algunos tienen nombres especiales, como los siguientes:
Sesión de Aprendizaje N° 08 - “¿Qué diferencia hay entre un grupo y un periodo?”
¿Cómo empezamos?
Observa la siguiente imagen:
Ahora, responde a las siguientes preguntas:¿Qué aprenderé hoy?
“A explicar la organización de los elementos químicos en grupos y periodos, mediante resolución de situaciones problemáticas, para entender la organización de la tabla periódica moderna”
¿Qué haré?
Clasificación de los elementos:
Triadas de Döbereiner (1817)
El químico alemán Johan Döbereiner (1780 - 1849) agrupa los elementos hasta entonces conocidos en serie de tres elementos llamándoselos Triadas. Los elementos que pertenecen a una triada poseen propiedades químicas semejantes.
Ejm.
 Octavas de Newlands (1864)
Octavas de Newlands (1864)
El químico inglés John Alexander Reina Newlands (1838 - 1898) ordeno los elementos químicos en grupo de 7 elementos cada uno, en función creciente a sus P.A. de tal modo que el octavo elemento tenía propiedades semejantes al primer elemento del grupo anterior. Esta forma de clasificar a los elementos se llamó Ley de las Octavas.
Ejm.
Tabla Periódica de Mendeléiev – Meyer (1869)
El químico ruso Dimitri Ivanovich Mendeléiev (1836 - 1907) y el químico alemán Julios Lotear Meyer (1830 - 1895), trabajando independientemente la Primera Tabla Periódica (T. P. Corta).
- Meyer Þ Prop. Físicas (volumen atómico)
- Mendeléiev Þ Prop. Químicas (valencia, E.O.)
Criterios:

- P.A. Creciente
- Dejaron espacios vacíos pronosticando el descubrimiento de nuevos elementos, hasta entonces había 63 elementos.
- La tabla posee 8 grupos.
Tabla periódica moderna:
También conocida como tabla periódica larga o de Werner y Paneth, se organiza en grupos y periodos.
Periodos: son siete filas de elementos designados con números del 1 al 7. El numero del periodo indica el nivel energético mas externo. Los periodos 1, 2 y 3 contienen pocos elementos, mientras que los periodos 4, 5, 6 y 7 son más largos.
Grupos: también llamados familias, están constituidos por las columnas. Los elementos de un mismo grupo tienen propiedades químicas semejantes. Hay dieciocho grupos (1 al 18). Algunos tienen nombres especiales, como los siguientes:
¿Qué aprendí hoy?
Es momento de describir lo que aprendimos, mediante la resolución de algunas situaciones:
¿Cómo empezamos?Observa la siguiente imagen:
Ahora, responde las siguientes preguntas:
¿Qué aprenderé hoy?
“A explicar la diferencia entre el número atómico del número de masa, mediante resolución de situaciones problemáticas, para entender que propiedades tiene el átomo”
¿Qué haré?
 Propiedades del núcleo atómico:
Propiedades del núcleo atómico:
El átomo es una estructura con un núcleo muy pequeño en relación con el tamaño total del átomo.
En el núcleo se encuentran los protones y neutrones.
Alrededor de este núcleo se mueven los electrones a una distancia muy grande en comparación con e tamaño de átomo. Es decir, la mayor parte del átomo esta vacía.
Para poder representarlo se utilizan un símbolo y dos números.
A partir de estos dos números podemos conocer muchos datos de los átomos. Por ejemplo, en los átomos de los elementos de cloro (Cl) y potasio (K)
Masa del átomo:
Es la medida de la cantidad de materia que posee:
- Calcular el número de masa (A) para el átomo de hierro (Fe), que tiene 30 neutrones:
¿Qué aprendí hoy?
SESIÓN VI
PROPIEDADES DE LA MATERIA
I. ¿CÓMO EMPEZAMOS?
OBSERVAMOS DETENIDAMENTE LA SIGUIENTE IMAGEN:
1. De acuerdo a la imagen ¿Qué características especiales presenta cada imagen?
2. ¿Para qué utilizamos cada objeto en nuestra vida cotidiana?
II. ¿QUÉ APRENDERÉ HOY?:
A explicar las propiedades de la materia, el fin que cumplen cada uno en la naturaleza y la vida cotidiana, a través del análisis de dichas propiedades.
III. ¿QUE HARÉ?
Revisar la información:

PROPIEDADES DE LA MATERIA
Las propiedades de la materia se clasifican en dos grandes grupos: generales o extrínsecas y especificas o intrínsecas.
1. Propiedades Generales: Son las propiedades que presenta todo cuerpo material sin excepción y al margen de su estado físico, así tenemos:
Ø Masa: Es la cantidad de materia contenida en un volumen cualquiera, la masa de un cuerpo es la misma en cualquier parte de la Tierra o en otro planeta.
Ø Volumen: Un cuerpo ocupa un lugar en el espacio
Ø Peso: Es la acción de la gravedad de la Tierra sobre los cuerpos. En los lugares donde la fuerza de gravedad es menor, por ejemplo, en una montaña o en la Luna, el peso de los cuerpos disminuye.
Ø Porosidad: Como los cuerpos están formados por partículas diminutas, éstas dejan entre sí espacios vacíos llamados poros.
Ø La inercia: Es una propiedad por la que todos los cuerpos tienden a mantenerse en su estado de reposo o movimiento.
Ø Elasticidad: Propiedad que tienen los cuerpos de cambiar su forma cuando se les aplica una fuerza adecuada y de recobrar la forma original cuando se suspende la acción de la fuerza. La elasticidad tiene un límite, si se sobrepasa el cuerpo sufre una deformación permanente o se rompe.
2. Propiedades especificas: Son aquellos que no dependen de la cantidad de materia, los más importantes son:
Ø Ductilidad: Propiedad por la cual los metales se pueden transformar hasta alambres o hilos.
Ø Fragilidad: es la tendencia a romperse o fracturarse.
Ø Densidad: Es la relación que existe entre la masa de una sustancia y su volumen.
Ø Punto de Ebullición: Es la temperatura a la cual una sustancia pasa de estado líquido a estado gaseoso.
Ø Punto de Fusión: Es la temperatura a la cual una sustancia pasa de estado sólido a estado líquido.
SOLUCIONARIO DE LA EVALUACIÓN DE LA SESIÓN 05
El punto de fusión de una sustancia se define como:
B) La temperatura a la cual la sustancia pasa del estado sólido al estado líquido.
El punto de condensación de una sustancia es la temperatura a la cual la sustancia cambia del estado
E) Gaseoso al líquido
Cuando la fuerza de cohesión (atracción) entre las partículas que forman una sustancia es menor que la energía interna las mismas, estás se separan unas de otras en movimiento aleatorio de forma tal que no posee una forma ni un volumen definido. Este estado es:
C) GASEOSO
Las lámparas fluorescentes que usamos a diario, contienen en su interior una sustancia que al ser excitada por la energía eléctrica ocasionan el salto de electrones de un nivel de energía a otro superior, posteriormente esa energía es liberada en forma de luz. El estado alcanzado por esas sustancias en el interior de los tubos bajo el efecto de la electricidad es:
D) PLASMA
El estado líquido presenta movilidad de las partículas, pero sin darse separación definitiva entre ellas, debido a esto este estado presenta las siguientes propiedades:
E) Fluidez, volumen constante y forma variable
La condensación corresponde al cambio de estado de:
C) gaseoso a líquido
El gas usado en nuestras casas se encuentra en qué estado
B) Líquido
Son necesarios para que ocurra un cambio de estado
C) El calor y la temperatura
¿Cuándo se transfiere calor a el líquido que pasa con las partículas?
B) Se separan cada vez mas
¿Qué es la cohesión?
A) Unión o adhesión entre dos o más cuerpos
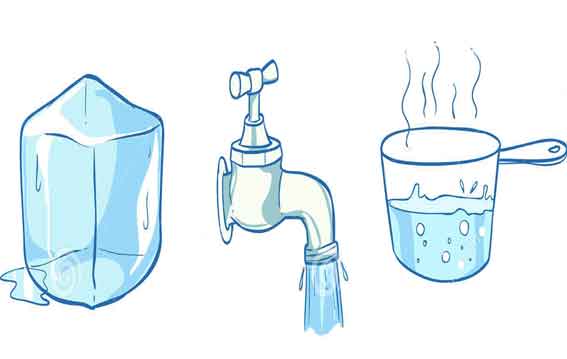
QUINTA SESIÓN
DOCENTE ABELARDO DÍAZ VÁSQUEZ / DOCENTE RICARDO HURTADO HUANCAYA
ESTADOS DE LA MATERIA
1. ¿Qué nos indica la imagen?
2. ¿Cómo estarán las moleculas de agua en hielo?
3. ¿Cómo estarán las moleculas de agua en el vapor?
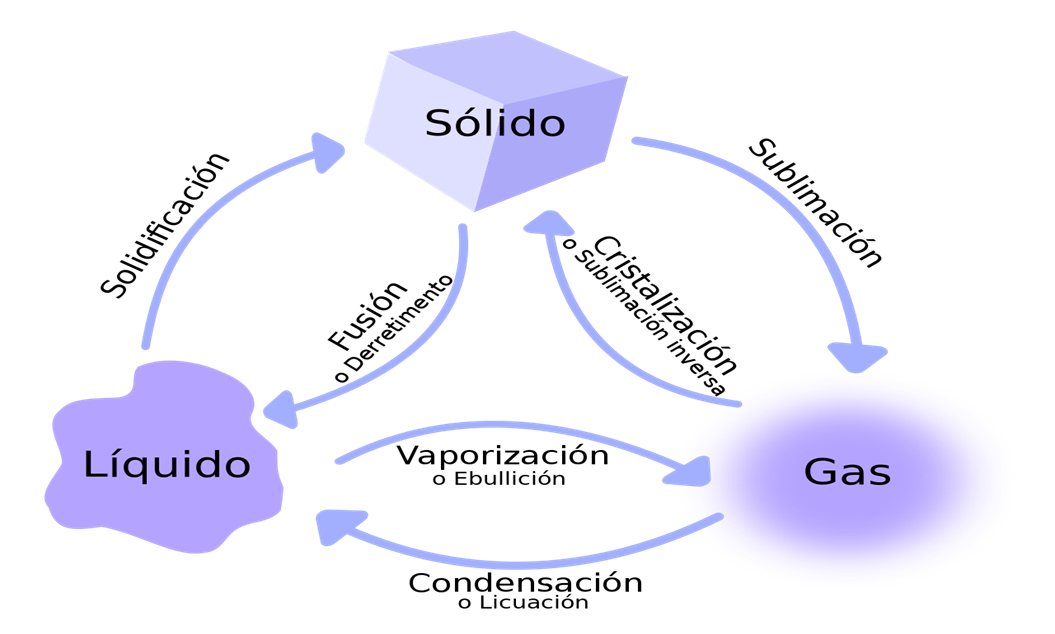
Conocer los cambios de estado de la materia mediante un diagrama
para comprender mejor dichos procesos.
Analizar el siguiente diagrama
































































No hay comentarios.:
Publicar un comentario